办理条件
1、广东省药品监督管理局发放的医疗器械注册证书(体外诊断试剂),注册证书在有效期内。
2、注册证书载明的注册人名称和住所、代理人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更;境内体外诊断试剂生产地址变更的,注册人应当在相应的生产许可变更后办理注册登记事项变更。3、纳入广东省医疗器械注册人制度试点的注册申请人还应同时符合以下条件:
(1)住所位于广州、深圳、珠海市辖区范围内,可以是企业、研发机构和科研人员
(2)委托在广东省行政区域内依法设立的企业生产本产品;
(3)应当配备专职的法规事务、质量管理、上市后事务等相关人员,以上人员应具有相应的专业背景和工作经验;
(4)具备医疗器械全生命周期管理能力,有对质量管理体系进行评估、审核和监督的人员和条件;
(5)具备承担医疗器械质量安全责任的能力,确保研制过程规范,所有数据真实、完整、可追溯。
(6)质量诚信良好,未有失信记录,未被纳入广东省药品监管“黑名单”。
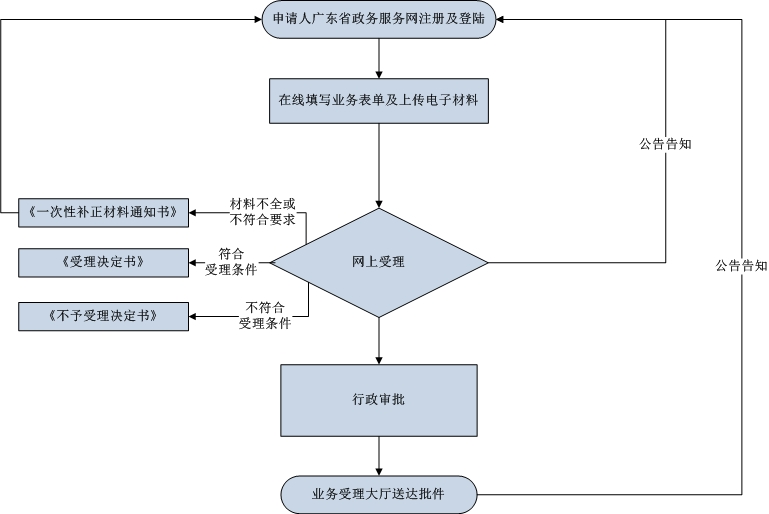
办理流程
申请材料
证明性文件
体外诊断试剂注册变更申请表
注册人关于变更情况的声明
原医疗器械注册证及其附件的复印件、历次医疗器械注册变更文件复印件
关于变更情况的申报资料要求
符合性声明
告知承诺制审批承诺书
申请材料形式标准
(1)申请材料应清晰、整洁,使用A4规格纸张打印
(2)每项文件第一页作标签,或用带标签的隔页纸分隔,并按资料目录标明项目编号
(3)每项文件均应加盖企业公章
(4)按照申请材料目录的顺序装订成册。
申报资料的具体要求
(1)申请表
(2)证明性文件
(a)企业营业执照副本复印件
(b)组织机构代码证复印件
(3)申请人关于变更情况的声明
(4)原医疗器械注册证及附件复印件、历次医疗器械注册变更文件复印件
(5)关于变更情况相关的申报资料要求
(a)注册人名称变更:企业名称变更核准通知书(境内注册人)和/或相应详细变更情况说明及相应证明文件。
(b)注册人住所变更:相应详细变更情况说明及相应证明文件。
(c)境内医疗器械生产地址变更:应提供相应变更后的生产许可证。
(6)符合性声明
a.注册人声明本产品符合《体外诊断试剂注册管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
b.注册人出具所提交资料真实性的自我保证声明。
办理依据
1、《体外诊断试剂注册管理办法》 第五十八条、 第六十条、 第六十一条
2、《医疗器械监督管理条例》 第十四条
办理时限说明
法定期限:登记事项变更资料符合要求的,食品药品监督管理部门应当即时办理。(《医疗器械监督管理条例》第十四条规定已注册的第二类、第三类医疗器械产品发生非实质性变化,不影响该医疗器械安全、有效的,应当将变化情况向原注册部门备案)
承诺期限:登记事项变更资料符合要求的,食品药品监督管理部门应当即时办理。(《医疗器械监督管理条例》第十四条规定已注册的第二类、第三类医疗器械产品发生非实质性变化,不影响该医疗器械安全、有效的,应当将变化情况向原注册部门备案)